梁勇教授课题组在全氟化合物干扰生物体脂类代谢的分子机制研究方面取得新进展,研究结果近日发表于环境领域一区杂志《Environmental Science & Technology Letters》(Perfluorooctanesulfonate Induces Hepatomegaly and Lipoatrophy in Mice through Phosphoenolpyruvate Carboxykinase-mediated Glyceroneogenesis Inhibition, DOI:10.1021/acs.estlett.0c00048)。
全氟辛烷磺酸PFOS是环境中最典型的全氟化合物,2009年被列入持久性有机污染物POPs名单。但由于PFOS具有较长的半衰期,即使被禁用或限制使用,其在环境和人体中还将长期稳定存在。因其结构上与脂肪酸类似,PFOS和PFOA等全氟化合物被证明具有脂类干扰效应,与高脂饮食一样可引起代谢相关的疾病如胰岛素抵抗、高血脂、心血管疾病等。
梁勇课题组前期的研究发现,PFOS暴露后的小鼠出现脂质累积导致的肝肿大,而白色脂肪组织却明显萎缩,这两个矛盾的表型并不能用常规的脂肪肝、糖尿病等致病机制来解释。肝脏和白色脂肪组织是生物体内脂类代谢的主要场所,两个器官/组织之间的甘油三酯循环对于维持生物体脂代谢平衡非常重要。考虑到甘油异生是生物体肝脏和脂肪组织间甘油三酯循环的重要生物途径,PFOS可能通过抑制甘油异生途径而干扰肝脏和白色脂肪组织间的甘油三酯代谢平衡,造成肝肿大和脂肪萎缩。最终证实肝脏和白色脂肪组织中甘油异生途径的限速酶磷酸烯醇式丙酮酸羧化酶(PEPCK)是PFOS的靶蛋白,PFOS可显著抑制小鼠肝脏和白色脂肪组织中PEPCK的基因和蛋白表达表达及酶活力。文章中还采用计算模拟的方法探索了PFOS与PEPCK蛋白活性口袋中关键氨基酸的分子相互作用,并在离体实验中证实了PFOS对PEPCK的抑制作用。
基于以上实验结果,此文证实了PFOS可促进白色脂肪组织中甘油三酯的分解,所释放的甘油和脂肪酸随血液循环到达肝脏重新酯化成甘油三酯,由于甘油三酯外运受到PFOS的抑制,肝脏中脂类物质随暴露时间延长而累积,造成肝肿大;在白色脂肪组织中,甘油异生受PFOS影响而受阻,甘油三酯合成因缺少甘油也被抑制,造成脂肪组织的持续萎缩。
在此基础上进一步建立了全氟化合物影响PEPCK活性的QSAR模型,可以科学预测各种结构全氟化合物的肝脏毒性大小,这为后续开发低毒高效的PFOS替代物提供了扎实的科学基础。
此项研究受到中国科学院战略性先导科技专项(B类)课题及国家自然科学基金委项目支持。
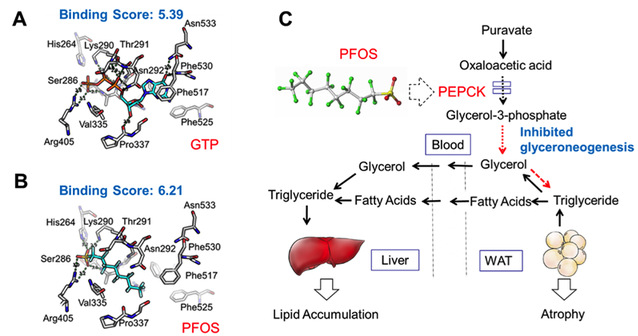
文章选图: PFOS通过抑制PEPCK造成肝内脂质累积及脂肪组织萎缩的作用机制

